本文作者:z_popeye
能口服的减重版司美格鲁肽,真的要来了?
近日,多家媒体报道,诺和诺德表示已于今年早些时候向 FDA 递交了新的申请,申请药物为 25mg 口服版司美格鲁肽,适应症则是「治疗超重或肥胖」。
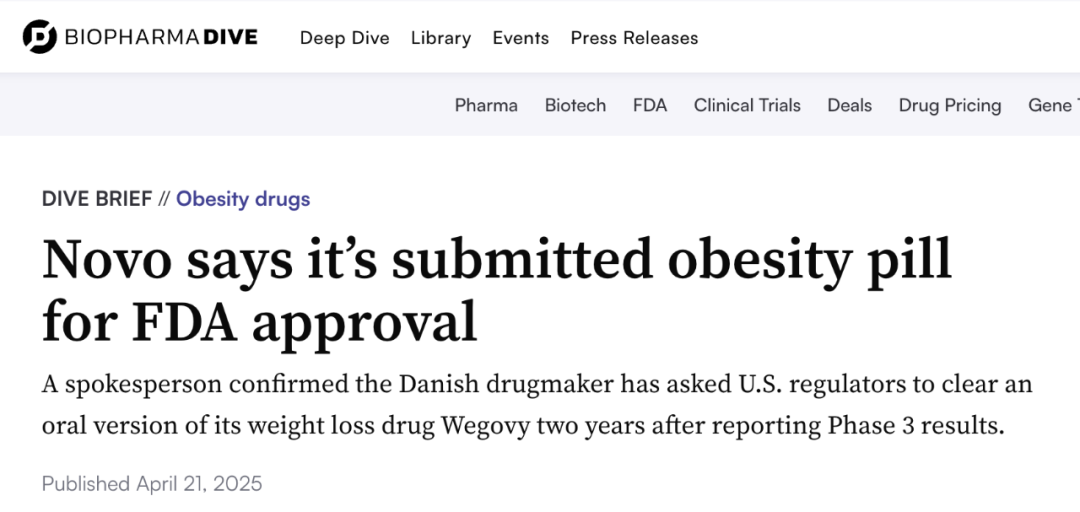
新闻截图
至此,司美格鲁肽再次斩获一个「第一称号」——全球第一个递交上市申请的口服减重版 GLP-1 药物。
68 周减 17.4%,减重效果不输注射剂型
诺和诺德的这个「第一」,要追溯回两年以前。
早在 2023 年 5 月,诺和诺德就公布了口服司美格鲁肽 50mg 治疗肥胖症的 OASIS 1 三期试验结果。
OASIS 是评估每日一次口服司美格鲁肽 25mg 和 50mg 治疗肥胖症的全球三期临床开发计划,共纳入约 1300 名肥胖/超重合并并发症患者,包含四项试验:
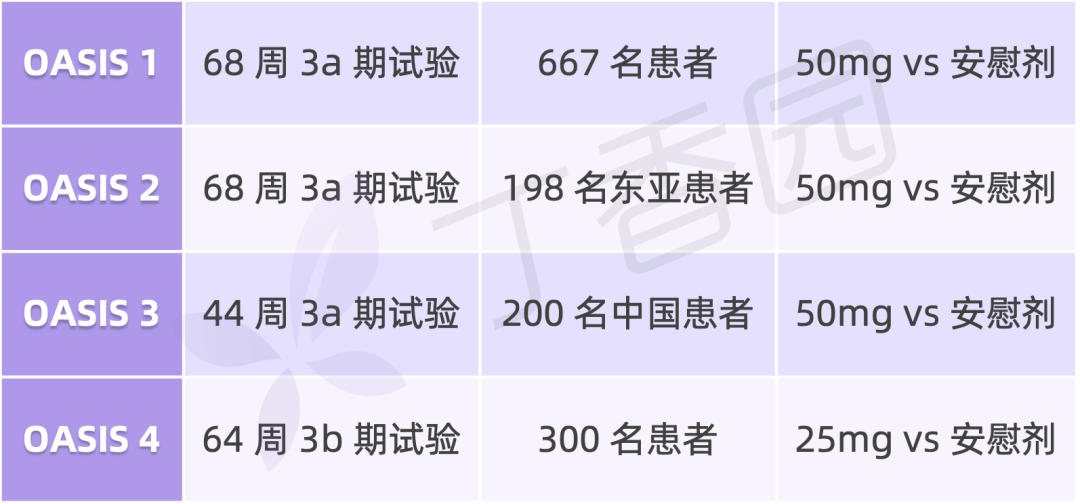
丁香园根据诺和诺德官网整理
在第一阶段研究中,口服司美格鲁肽就展现出了不错的效果。

诺和诺德官网截图
据诺和诺德公布数据,基线平均体重 105.4kg 的治疗人群中,口服司美格鲁肽 50mg 组患者 68 周后体重降幅达 17.4%(安慰剂组为 1.8%),差异具有统计学显著性。此外,89.2% 的药物治疗组患者实现 ≥5% 体重减轻(安慰剂组 24.5%)。
在安全性方面,口服司美格鲁肽 50mg 耐受性良好,主要不良事件为胃肠道反应(多数为轻中度且随时间缓解)。
诺和诺德开发执行副总裁直言:口服司美格鲁肽在临床研究中的表现,与已经上市的注射剂型司美格鲁肽 2.4mg 相比「毫不逊色」。
在此前针对注射剂型司美格鲁肽的 STEP 1 研究中,1961 名超重或肥胖患者里司美格鲁肽 2.4mg 组 68 周平均体重降幅达 14.9%(安慰剂组为 2.4%),86.4% 的患者体重减轻 ≥5%(安慰剂组 31.5%)。
有了研究数据给的底气,OASIS 1 结果发布当时,诺和诺德就表示计划于 2023 年向美国和欧盟提交上市申请。
但没想到,这一计划,就是 2 年。
迟来的口服减重版司美,被什么「耽误」了?
这样一件「利器」,为何要直到 2025 年才姗姗来迟推进上市?
实际上,在 2024 年宣布上市申请计划的同时,诺和诺德就给大家打过一次预防针:「上市取决于产品组合的优先级和生产能力。」
彼时,令诺和诺德头疼的第一件大事是产能。
减重版司美格鲁肽获批以来,可谓大受欢迎。上市第一年诺和诺德就屡次修改生产计划和销售前景——不是不想卖,是真干不动了。
就在公布 OASIS 研究的前一种,诺和诺德还刚刚紧锣密鼓地宣布将增加第二家合同制造商。甚至公司一度暂停了减重版司美格鲁肽的广告宣传,试图给热情的患者们泼点冷水降降温。
而与此同时,礼来的后起之秀替尔泊肽正迎头直追。2022 年 5 月获得 FDA 批准用于糖尿病,成为首个获批的 GIP/GLP-1 双重受体激动剂,同时紧追减重适应症,力求在 2023 年之内斩获。
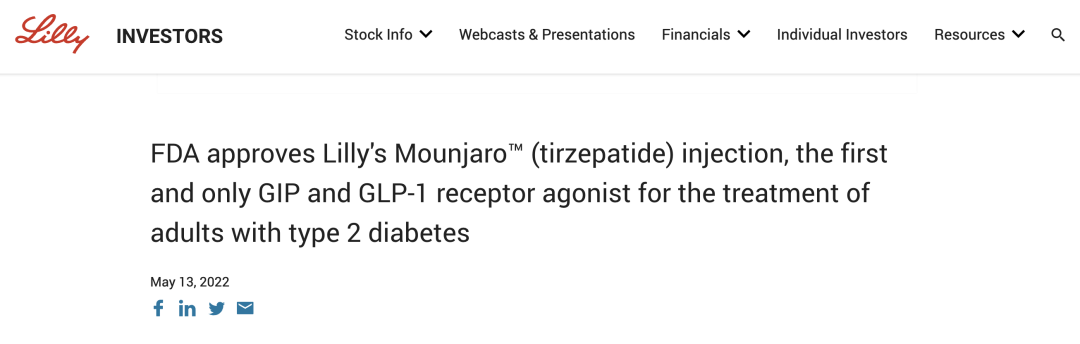
替尔泊肽成为首个获批的 GIP/GLP-1 双重受体激动剂(图源:礼来官网截图)
在这样的局势下,对于诺和诺德而言,与其分出额外的生产线来推进口服版新药,不如死磕「走量」这条路,在替尔泊肽拿下减重适应症之前,尽量占有更多市场份额。
另一方面,当时的诺和诺德还押宝于另一款正在研发中的药物 Cagrisema。
Cagrisema 结合了司美格鲁肽和另一种名为卡格林肽(Cagrilintide)的长效胰淀素类似物,理论上可以抑制饥饿感,并有助于控制患者的血糖,每周注射一次。
据诺和诺德电话会议记录,管理层原本希望 Cagrisema 在试验期间能带来约 25% 的减重效果,以超越替尔泊肽的 21%。还有调查显示,投资者原本预计,Cagrisema 的减重效果将高达 27%。
然而,Cagrisema 随后的走向却不如想象乐观。
根据 2024 年 12 月公布的数据,Cagrisema 帮助患者在 68 周后减掉高达约 23% 的体重,比接受安慰剂治疗的患者高出约 20%,比单独接受该司美格鲁肽治疗的患者高出 7%。

诺和诺德官网截图
虽然这个数看上去已经不低了,但在卷生卷死的 GLP-1 赛道上,显然还不够。
不仅如此,由于患者可以在试验期间调整剂量。试验结束时,接受 Cagrisema 的患者中只有约 57% 使用了最高剂量,低于单独接受司美格鲁肽的患者(约 70%)和单独接受卡格林肽的患者(约 83%)。
诺和诺德在应声下跌的股价中,迎来了 2025 年。
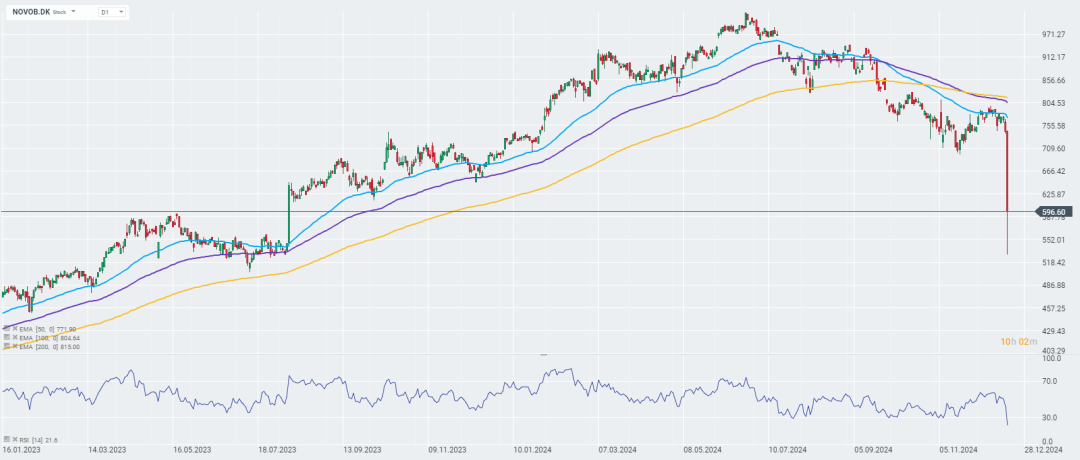
在 Cagrisema 结果公布后,诺和诺德股价走向(图源:xtb.com)
GLP-1 步入口服战场,谁能弯道超车?
2025 年 4 月 17 日,礼来公布了口服 GLP-1 药物 Orforglipron 的 3 期临床试验 ACHIEVE-1 的结果。

礼来官网截图
ACHIEVE-1 是一项为期 40 周的三期随机、双盲、安慰剂对照试验,比较 Orforglipron 3mg、12mg 与 36mg 单药与安慰剂在饮食与运动血糖控制不佳的 2 型糖尿病成人患者中的疗效与安全性。
结果显示,Orforglipron 在给药过程中平均将糖化血红蛋白降低 1.3~1.6%,在关键次要终点中,每日一次口服药丸在最高剂量下平均减轻了 16.0 磅(7.9%)的体重。
礼来表示,预计于今年底向全球监管机构提交 Orforglipron 的体重管理适应症申请,并于 2026 年提交其治疗 2 型糖尿病的申请。
这里就要画个重点了。
诺和诺德的口服版司美格鲁肽仍然秉持着传统的「先降糖后减重」,但这次,注射剂型上一直撵着别人尾灯跑的礼来,决定来一把「排水渠过弯」——先减重,再降糖!

图源:《头文字 D》截图
事情发展到这个地步,到底谁能争上这个「全球首个」的帽子,就显得很重要了。
司美会迟到,但不会缺席。在礼来公布结果的 4 天后,诺和诺德放出话来,已申请口服司美格鲁肽的减重适应症。
不过,就算诺和诺德能抢占审批的先机,不意味着礼来就没有翻盘的机会。
一方面,礼来的 Orforglipron 有一大特点,它是一种小分子非肽药物,在生产规模化、分发便利性大大优于肽类注射剂。
礼来公司董事长兼 CEO 很有信心地表示:「如果获得批准,Orforglipron 可以轻松生产并大规模上市,供世界各地的人们使用。」
而另一方面,令诺和诺德头疼的产能老问题,很可能在口服减重版司美格鲁肽获批后再次上演。
毕竟,注射剂型的司美格鲁肽一支是 2.4mg,每周一针;口服减重的司美格鲁肽则是 25mg 规格的,还需每日服用……
但无论如何,总而言之,在这个即将结束的 4 月,GLP-1 药物的口服新战场已经打响了第一枪。

图源:《猫和老鼠》截图
除了如火如荼的双寡头外,其他药企也都在摩拳擦掌,希望加入这场角逐。
不过,并非所有的尝试都一帆风顺。
同样在这个 4 月,辉瑞发布口服 GLP-1 受体激动剂 Danuglipron 的最新进展:在一项剂量优化研究中,一名参与者出现了潜在的药物性肝损伤,停用后病情得到缓解。
经过详细审查,辉瑞遗憾表示将停止该分子的开发。
辉瑞首席科学官兼研发总裁表示:「虽然我们对停止 Danuglipron 的开发感到遗憾,但我们仍致力于评估和推进有前景的项目,努力为患者带来创新的新药。」
回到国内,中国药企也在加速追赶中。
目前,恒瑞医药的口服 GLP-1R 药物 HRS-7535 已启动 III 期临床,主要终点为治疗 50 周后体重降幅及减重 ≥5% 的患者比例。还另有一项 III 期临床,针对饮食与运动控制不佳的 2 型糖尿病患者,探索降糖与减重的双重作用。
同为 GLP-1R 靶点的闻泰医药 VCT-220 也已于去年 11 月进入 III 期临床,适应症为肥胖和代谢性疾病。
此外,去年 12 月,翰森制药宣布将口服 GLP-1 受体激动剂 HS-10535 的开发、生产和商业化全球独家许可权授予默沙东,有望卖出高达 19 亿美元的价格……
这场趋于白热化的口服之争中,谁能拔得头筹,还未可知。(策划:z_popeye|监制:islay)
编辑:ifhealth 来源:丁香园
